|
卵巢癌(ovarian cancer,OC)是世界上死亡率最高的妇科恶性肿瘤[1],全球每年新发OC约22万例,死亡14万例,且近年来发病率呈逐年上升趋势[2]。OC患者早期无特异性临床症状,发病较为隐匿[3],大约75%患者确诊时为中晚期[4],治疗效果及预后较差,5年生存率不到30%,对女性生命健康造成严重威胁[5]。目前Ⅰ期OC患者5年生存率可以达到90%,Ⅲ~Ⅳ期却不足10%[6],因此对OC患者进行及早诊治是提高其生存率的关键。CA125是目前应用最广泛的用于OC早期筛查的肿瘤标志物,它对OC的诊断和病情监测有一定的意义,但敏感度和特异度均不够理想[7]。因此寻求OC早期筛查的敏感指标对于提高OC患者总体生存率具有重要意义。乳酸脱氢酶(lactate dehydrogenase,LDH)是一类将丙酮酸转化为乳酸的糖酵解酶,癌细胞的生长、侵袭和转移都需要LDH的参与[8],LDH于诸多恶性肿瘤中升高,如OC[9,10,11]。α-HBDH是LDH的同工酶,实际反映的是体内LDH1和LDH2的总体水平,多项研究表明α-HBDH在多种恶性肿瘤中升高[12,13],然而目前与OC的相关性研究国内外鲜见报道。本研究旨在通过对OC组、卵巢良性病变组、正常对照组的血清α-HBDH浓度进行检测并分析其在不同临床病理特征的变化,探讨其在OC及早期OC中的临床价值,为今后α-HBDH在OC的辅助诊断、治疗监测提供参考。选取2014年1月至2018年8月在浙江大学医学院附属妇产科医院确诊治疗的OC患者319例作为OC组及卵巢良性病变患者400例为良性组。纳入标准:(1)经术后病理证实为卵巢良恶性病变;(2)患者及家属均知情同意。排除标准:(1)术前采取放疗或者化疗等治疗措施;(2)妊娠期、哺乳期女性;(3)有心、脑、肝、肾等重要脏器疾病。同期选取健康体检者400名作为正常组,并排除卵巢疾病且无心、脑、肝、肾等重要脏器疾病。所有受试者均知情同意,本研究通过本院伦理委员会审批,批号:20190056。按照2014国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)诊断标准,分为(Ⅰ~Ⅳ期)。OC组年龄14~78岁,平均(49.0±12.4)岁;良性组年龄12~78岁,平均年龄(48.5±12.3)岁;正常组年龄24~88岁,平均年龄(47.8±14.9)岁,各组年龄之间具有可比性(F=0.4,P=0.664)。同时按照是否绝经,将所有研究对象分为未绝经组和绝经组,所选OC组、良性组和正常组病例在是否绝经以及年龄之间均具有可比性(χ2=1.5,P=0.478;χ2=1.0,P=0.598),见表1。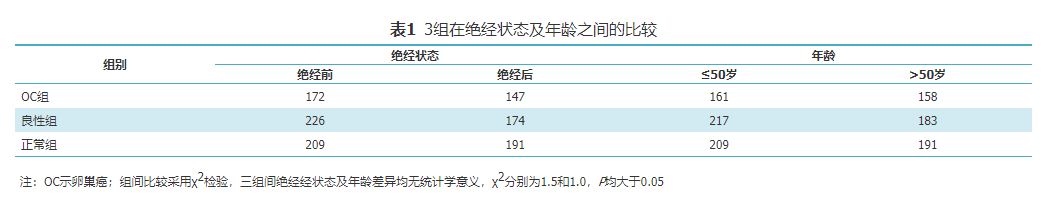
OC组、良性组于入院第2天清晨空腹抽取外周静脉血3 ml,健康体检者于体检当天清晨空腹采集外周静脉血3 ml置于真空采血管中,充分混匀后静置20 min,2 000×g离心10 min,取上清液采用电化学发光法检测血清α-HBDH和CA125水平。α-HBDH检测仪器为美国雅培公司i2000全自动微粒子化学发光免疫分析仪,配套试剂购于北京中生北控生物科技股份有限公司;CA125检测仪器为瑞士罗氏公司Cobas e601全自动电化学发光免疫分析仪,试剂为罗氏原装配套试剂。所有操作均严格按照仪器操作SOP进行。统计学方法采用SPSS 19.0统计学软件进行分析。正态分布计量资料,实验结果以±s表示,多组间比较用单因素方差分析;非正态分布计量资料以中位数(四分位数)[M(P25~P75)]描述,其两组间比较用Wilcoxon秩和检验,多组间比较采用Kruskal-Wallis H检验;计数资料组间比较采用χ2检验;等级资料相关性分析采用Spearman相关分析。用MedCalc18.2.1软件绘制ROC曲线及评价所观察指标的诊断性能,并计算AUC。最佳的诊断效率根据约登指数(Youden index,YI)得出。P<0.05为差异有统计学意义。OC组、良性组及正常组血清α-HBDH浓度分别为134.0(114.0~168.0)、120.0(104.0~133.0)和110.0(100.0~126.0)U/L,α-HBDH表达水平在正常组、良性组和OC组中依次逐渐升高,且差异具有统计学意义(H=129.5,P<0.001),见表2。在未绝经组中,OC组、良性组及正常组血清α-HBDH浓度分别为121.0(108.0~153.0)、113.0(98.0~128.0)和104.0(93.5~117.5)U/L,见表2;在绝经组中,3组血清α-HBDH浓度分别146.0(126.0~172.0)、127.0(111.0~140.0)和119.0(105.0~132.0)U/L,见表2。在未绝经组和绝经组中,血清α-HBDH的表达水平在正常组、良性组和OC组中依次逐渐升高,差异均具有统计学意义(H=63.8,P<0.001;H=89.1,P<0.001)。此外,OC组、良性组及正常组血清α-HBDH浓度在绝经组的表达均高于未绝经组,差异均具有统计学意义(Z=-5.2,P<0.001;Z=-5.7;P<0.001;Z=-6.5,P<0.001)。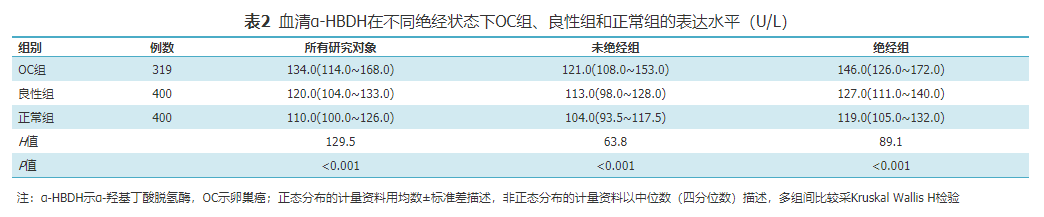
表2 血清α-HBDH在不同绝经状态下OC组、良性组和正常组的表达水平(U/L)
在OC患者中,血清α-HBDH水平从Ⅰ期到Ⅳ逐期升高,且总体差异具有统计学意义(H=31.5,P<0.001),见表3。将FIGO分期与血清α-HBDH水平进行相关性检验,结果显示FIGO分期与血清α-HBDH水平呈正相关(R=0.3,P<0.001)。通过对不同FIGO分期之间的比较分析,结果显示,Ⅲ期和Ⅳ期表达水平高于Ⅰ期,差异均具有统计学意义(Z=-4.4,P<0.001;Z=-4.0,P<0.001);此外,Ⅳ期表达水平高于Ⅲ期,差异具有统计学意义(Z=-2.4,P=0.015)。通过对淋巴结是否发生转移进行比较分析,结果显示淋巴结发生转移患者血清α-HBDH水平高于淋巴结未发生转移患者,差异具有统计学意义(Z=-3.2,P<0.001),见表3,同时将是否出现淋巴结转移与血清α-HBDH水平进行相关性检验,结果显示淋巴结转移与否与血清α-HBDH水平呈正相关(R=0.2,P=0.001),但血清α-HBDH表达水平与病理类型无统计学差异(Z=-1.5,P=0.133),见表3。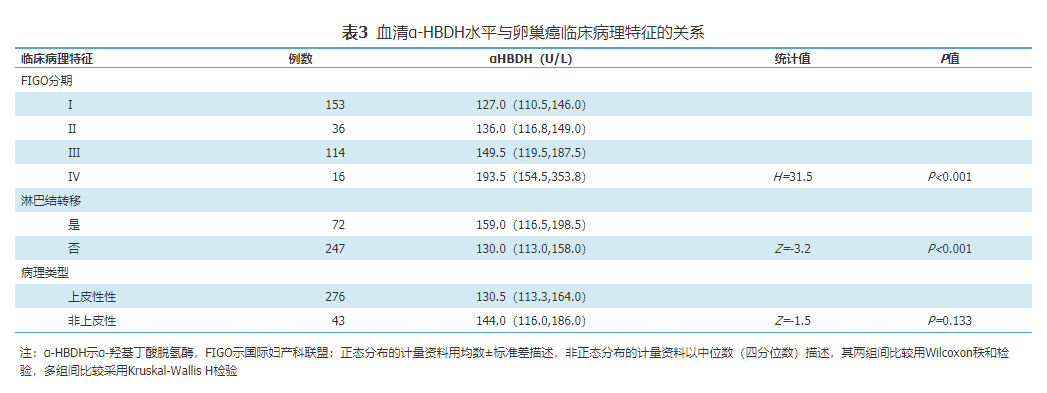
表3 血清α-HBDH水平与卵巢癌临床病理特征的关系
三、血清α-HBDH、CA125诊断不同绝经状态OC的效能评价根据α-HBDH在不同绝经状态的差异表达,按照是否绝经将OC分为未绝经组和绝经组。在未绝经组中,以未绝经良性组+未绝经正常组为参照,在绝经组中,以绝经良性组+绝经正常组为参照分别绘制ROC曲线,通过AUC来判断诊断价值大小。结果显示,在未绝经组中,α-HBDH、CA125的曲线下面积分别为0.685和0.796,见图1A。当截断值设为104.0U/L时,α-HBDH的诊断敏感度为83.14%,特异度为43.68%;当CA125截断值为34.6U/ml,此时CA125诊断敏感度为70.93%,特异度为76.78%。在绝经组中,α-HBDH和CA125的AUC分别为0.749、0.915,见图1B。当截断值设为138.0 U/L时,α-HBDH的敏感度为61.22%,特异度为78.36%;当CA125截断值为23.5U/ml,CA125诊断敏感度为82.31%,特异度为92.33%。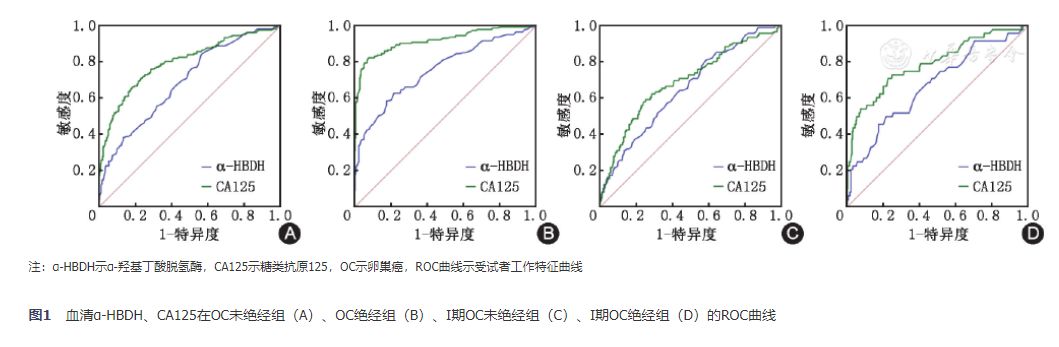
图1 血清α-HBDH、CA125在OC未绝经组(A)、OC绝经组(B)、Ⅰ期OC未绝经组(C)、Ⅰ期OC绝经组(D)的ROC曲线
在Ⅰ期OC检测中,AUC结果显示α-HBDH在未绝经组中的诊断性能接近CA125[α-HBDH(AUC:0.646);CA125(AUC:0.691)];α-HBDH在绝经组中诊断性能低于CA125[α-HBDH(AUC:0.666);CA125(AUC:0.789)],见图1C, 图1D。在Ⅰ期OC未绝组中,当截断值根据约登指数设为103.0 U/L时,α-HBDH的诊断敏感度达到79.41%,特异度为41.61%;当CA125截断值为31.9 U/ml,此时CA125诊断敏感度仅为58.82%,特异度为74.71%,见表4。
表4 α-HBDH和CA125对Ⅰ期卵巢癌的诊断价值
LDH是糖的无氧酵解和糖异生的重要酶类之一,广泛存在于心脏、肝脏和人体各组织内,它在恶性肿瘤的发生、发展、侵袭和转移中扮演重要角色[14]。研究数据表明,血清LDH水平还可作为预测肿瘤预后的指标之一[15,16,17]。α-HBDH是含H基团的LDH1和LDH2的总称,是LDH在其他基质上发挥作用的重要酶类物质,它以心肌组织中含量最高,其活性达总酶活力的一半以上,如若发生心肌疾病时,α-HBDH可明显增高[18]。本研究发现血清α-HBDH的表达水平在正常组、良性组和OC组中依次逐渐升高,且差异具有统计学意义(H=129.5,P<0.001)。考虑到前期研究中已经排除了心脏病变的患者纳入实验组,因此α-HBDH水平的升高确实可能反映OC的发生。在肿瘤微环境中,由于代谢加速,OC细胞增生和破坏都较正常细胞快,所以恶性肿瘤一旦发生,细胞内的酶迅速释放到血液中,引起血中α-HBDH活性增加,这与本研究结果一致。目前OC的主要治疗方式为根治性手术治疗,而对OC患者术前全身情况进行系统客观的评估对于手术治疗效果及远期预后具有重要意义[19]。淋巴结转移与否可为患者手术方式、术中淋巴结的清扫方式及范围提供重要参考。目前影像学检查是评估OC患者淋巴结转移的重要方式,但是存在方法单一等局限性。本研究通过对OC患者的临床病理特征分析,结果显示淋巴结转移与未转移患者相比,其血中α-HBDH活力较高。此外,血清α-HBDH水平和FIGO分期呈正相关,且差异具有统计学意义(H=31.5,P<0.001),综上所述,血清α-HBDH水平的增高可能与OC病情相关,可以为OC患者淋巴结转移的预测、疾病分期的判断提供参考。OC早期症状不明显,约75%的患者确诊时已处于晚期,死亡率较高[4]。据统计,目前Ⅰ期诊断者5年生存率可达90%,但临床上在此阶段被确诊的仅有15%[20]。CA125是目前临床应用最广的OC筛查标志物,但其对早期OC的诊断敏感度不高,对出现临床症状和体征后的患者特异度亦不高[7],同时CA125在子宫内膜异位症、盆腔炎症性包块等其他疾病中均有不同程度的升高[21],故用于OC的早期筛查仍有不足。在本研究中发现α-HBDH在不同绝经状态下表达差异具有统计学意义(Z=-5.2,P<0.001),在将OC患者分为未绝经组和绝经组后,经过统计分析,无论在绝经组还是非绝经组,α-HBDH对OC的诊断效率均低于CA125。其中在绝经组中,CA125无论在敏感度还是特异度上,均高于α-HBDH,但在非绝经期中,α-HBDH在敏感度上优于CA125(83.14%和70.93%)。为进一步判断α-HBDH、CA125对早期OC的诊断效能,本研究通过对153例Ⅰ期OC患者进行ROC比较分析,尽管在绝经后OC诊断效率上α-HBDH低于CA125,然在Ⅰ期非绝经组的比较中,α-HBDH诊断性能与CA125接近,但敏感度却明显高于CA125,其中α-HBDH的诊断敏感度达到79.41%,CA125诊断敏感度仅为58.82%。据研究报道,早期OC患者血清CA125水平显著低于晚期,可能原因为早期肿瘤病灶较为完整或肿瘤脱落的抗原较少,因此不易检出,导致血清CA125对早期OC患者检出率相对较差,其Ⅰ期敏感度仅为50%左右[6],这与本研究结果相符,容易导致临床上漏诊或误诊。因此寻找早期更高诊断敏感度的标志物意义重大,在本研究中,α-HBDH在Ⅰ期非绝经患者的诊断敏感度高于CA125,故α-HBDH可以弥补CA125诊断敏感度的不足,而CA125可以提高诊断的特异度,故将二者结合起来判断从而提高Ⅰ期非绝经OC患者的诊出率,进而达到早发现早治疗的目的。综上所述,血清α-HBDH水平在OC患者中表达升高,与OC的疾病进展密切相关,可为非绝经OC患者,尤其是非绝经Ⅰ期非绝经患者提供辅助诊断价值。 |