|

继今年2月24日,FDA授权了首个非处方家庭分子检测试剂Lucira COVID-19 & Flu Home Test后,FDA于2023年11月9日又批准了首个针对COVID-19的非处方(OTC)抗原检测试剂- ACON Laboratories的Flowflex COVID-19抗原家庭检测试剂。这为后续计划申请新冠抗原510(K) 的企业铺平道路。
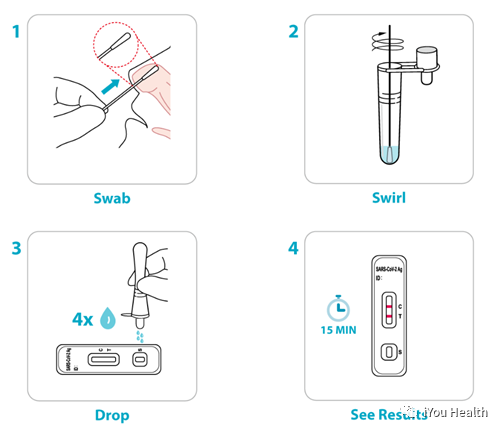

这款产品不仅成为第二款成功通过传统FDA上市前审查途径的家庭COVID-19测试产品,更是首个适用于18岁以下儿童的检测产品。我们来看下这个产品的主要声称: 取样方式 | 前鼻拭子 | 检测标的 | 用于定性检测SARS-CoV-2病毒的核衣壳蛋白抗原 | 使用场景 | 非处方/自测 | 患者类型 | 有新冠感染症状的患者 | 测试窗口期 | 症状出现后6天内在家中使用 | 适用年龄 | 14岁及以上年龄自测,2岁及以上由成年人测试 | 读取结果时间 | 15-30分钟 | 连续测试 | 有症状的患者,首次测试阴性后,需要在48~72小时内用抗原,或分子试剂重测 |
K230828包含了如下性能测试: Multi-lot Precision精密度:3名操作员进行10天的盲法测试。所有三个批次都在每个测试日由每个操作员进行测试。每个样本级别在每个操作员每天两次运行中重复测试(即,3批x3个操作员x2次重复/运行x2次运行X 10天)。每个小组成员总共进行了360次测试。
Analytical Specificity/Interference: (Cross Reactivity/Microbial Interference & Interfering Substances: 分析特异性/干扰(交叉&干扰实验):对35种潜在交叉物和31种潜在干扰物,每种进行3个重复检测。并对 SARS-Coronavirus和Pneumocystis jirovecii的潜在交叉反应做了In silico的分析。
Sample Stability样本稳定性: 将热灭活的标品加入阴性鼻拭子基质,生成模拟阳性鼻拭子样本。在不同温度条件下存储阴性和阳性拭子1至4小时,然后用产品进行每个5次重复测试。
Device Stability实时稳定性:3批次试剂盒在2-8°C和30°C下保存27个月后测试。用来支持24个月的有效期。
Shipping Stability运输稳定性:3批次产品存储在三个不同的温度条件:(1)60℃ 85% ±5%相对湿度,(2)室温(25℃)和(3)2~8℃ 8天。每天检测5个重复。
Detection Limit最低检出限: 用了两种方法验证LOD,一种是FDA推荐的传统方法,将标品梯度稀释后用20个replicates来确认。另一种是WHO的SARS-CoV-2抗原国际标准(NIBSC代码:21/368)来确定。
High Dose Hook Effect 高剂量钩子效应:用高浓度标品培养液对每个批次重复试验5次。
Inclusivity (Analytical Reactivity)包容性 :验证了产品对7种新冠毒株的包容性。
Matrix equivalency study基质等同研究:进行了基质等效性研究,比较了阴性临床鼻拭子基质和含有1%粘蛋白的PBS替代基质。结果表明,这两种基质在测试性能上相似,具有相同的效果。
Flex Studies弹性研究:评估了样品量、读数时间、萃取缓冲量、试剂管气泡、拭子洗脱时间和过程、处理前和处理过程中的样品保持时间、运行期间干扰、设备方向、照明、各种温度和湿度应力条件。
2022年12月至2023年2月期间开展了前瞻性临床研究,在9个临床点招募了有症状患者799人,包括约22%的弱阳性样本。每人取一个鼻咽拭子和一个自测拭子。对比试剂为FDA EUA授权的RT-PCR, 临床结果PPA为89.8%,NPA为99.3%。 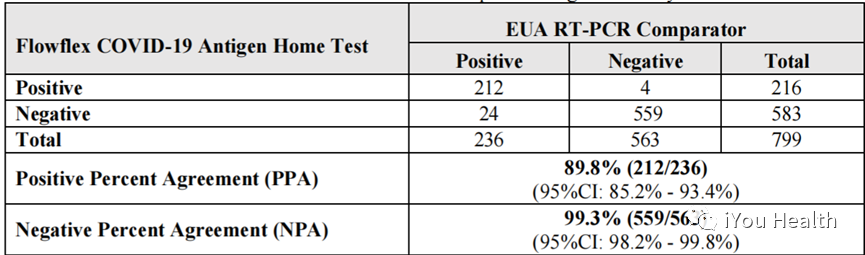
在可用性研究中,共纳入431名18岁及以上的受试者,共有98.8%的人通过获得阴性或阳性的结果成功完成了检测。值得一提的是,Acon’s Flowflex COVID-19抗原家庭检测试剂本是一款EUA产品,此次510(k)申报并未采用之前EUA的临床数据,仍然新做了近800个测试。

FDA设备与放射卫生中心主任Jeff Shuren博士表示:“这标志着我们努力帮助测试开发者为美国民众提供可以在家使用的安全有效的COVID检测方法的最新进展。”他强调FDA正在积极与希望将产品推广至紧急使用之外的测试开发者合作。这与FDA推动家庭用于多种医疗状况测试的更广泛使命相符,以提高患者进行检测的便利性。 家用测试越来越成为一种趋势。ACON的Flowflex COVID-19家用抗原测试的获批,为其它类似产品提供了对比试剂,铺平了道路。 以我们过往为多家企业申请的经验和此次ACON的临床研究周期看来,如果能赶在COVID流行季节,完成所有临床研究,预计需要3-4个月左右的时间。如果企业希望申请COVID-19+FluA/B(或再加RSV)联检家用测试,视疾病流行的种类和周期,需要的时间会更长,可以尽早做准备。

注:除文章中专门注有的出处外,其它资料均来源于各政府和非政府公共网站,多途径非机密性信息源,以及我们的实践经验积累。此页面上的信息截至2023年11月有效,考虑到立法监管规定及市场在不断更新变化,科学技术也在不断进步,作者不能保证在本页面发布同时或之后所传送的信息完全准确。内容仅供读者阅读参考。若有不当之处请及时联系我们。@文章版权归XYZ Health Group所有。
|