|
本文刊于:中华儿科杂志,2019,57(8): 597-602 作者:王高良 华春珍 杨林海 邓慧玲 许红梅 俞蕙 王世富 张聪慧 单位:浙江大学医学院附属儿童医院 摘要 目的 探讨人巨细胞病毒(HCMV)gH基因分型与先天性巨细胞病毒感染临床特征的关系。
方法 采用队列研究,选取2013年7月至2015年12月在浙江大学医学院附属儿童医院新生儿科及新生儿重症监护室(NICU)住院确诊为先天性巨细胞病毒感染的21例患儿,检测尿液、痰液或血液HCMV gH基因分型,根据gH基因分型结果将患儿分为gH1组和gH2组。收集患儿新生儿期住院资料和3~5年随访资料。应用χ2检验、t检验、非参数检验分析gH基因分型与患儿临床表现、实验室检查、听力损失、神经系统预后的相关性。
结果 21例患儿中gH1型14例(67%)、gH2型7例(33%),未发现混合感染病例。两组男性比例(9/14比3/7,Fisher概率法,P=0.397)、出生体重[(2 609±686)比(3 021±451)g,t=-1.436,P=0.167]差异均无统计学意义。gH1组出生胎龄小于gH2组[38(29~40)比39(38~40)周,Z=-2.18,P=0.029]。40耳(20例)进行新生儿期脑干诱发电位听力测试,gH1组中重度及以上听力损失比例高于gH2组(4/22比0/18,χ2=5.145,P=0.023)。神经系统影像学检查Alarcon评分gH1组低于gH2组[(0.4±0.3)比(1.3±1.1)分,t=-2.459,P=0.024]。gH2组出现运动或语言发育落后的概率与gH1组差异无统计学意义(4/7比4/14,Fisher概率法,P=0.346)。
结论 gH1型感染较gH2型感染新生儿出生胎龄小。新生儿期中重度及以上听力损失以gH1型感染为主。gH2型先天性感染患儿出现神经系统损害的可能性较大。
先天性人巨细胞病毒(human cytomegalovirus, HCMV)感染是新生儿常见的先天性病毒感染性疾病之一,也是导致新生儿非遗传感音性神经性耳聋(sensorineural hearing loss, SNHL)和神经发育迟缓的重要原因之一。由于新生儿大部分为无症状感染,容易被忽视,早期进行HCMV筛查,有针对性地进行管理和随访对临床诊治尤为重要。包膜糖蛋白是病毒最外层的脂质双层包膜主要成分,在病毒进入细胞、细胞与细胞之间扩散及感染致病机制中起重要作用[1]。gH基因可分为gH1和gH2两型,我国gH基因型别差异与先天性HCMV感染临床表现、预后的相关性研究较少,本研究于2013年7月至2015年12月对21例先天性巨细胞病毒感染新生儿进行HCMV gH基因分型检测,收集新生儿住院期间的临床表现、实验室检查、听力检查、神经系统影像学资料和3~5年随访资料,旨在进一步分析HCMV gH基因分型与先天性HCMV感染临床特征的关系。
采用队列研究。以2013年7月至2015年12月在浙江大学医学院附属儿童医院新生儿科及新生儿重症监护室(neonatal intensive care unit,NICU)住院确诊为先天性HCMV感染并行尿液、痰液或血液HCMV gH基因分型的21例新生儿为研究对象。本研究通过浙江大学医学院附属儿童医院伦理委员会批准,审批号2015-PIRB-002。已取得患儿家长的知情同意。纳入标准:(1)符合先天性HCMV感染的诊断标准[2],3周龄内尿液样本实时荧光定量(real-time fluorescence quantitative,RTFQ)PCR阳性者确诊先天性HCMV感染。(2)行尿液、痰液或血液HCMV gH分型。出现以下症状考虑症状性感染[3],小于胎龄儿(small for gestational age,SGA)(相同胎龄平均体重的第10个百分位以下)、淤斑、肝大(肋下≥2 cm)、脾大(肋下≥2 cm)、小头畸形(头围/体重<正常2个标准差)、脉络膜视网膜炎、肝炎[丙氨酸转氨酶(alanine>100 U/L]或胆汁淤积[直接胆红素(direct bilirubin,DBIL)>51 μmol/L]、颅内钙化。分组标准:根据gH基因分型,将患儿分为gH1组和gH2组。排除标准:新生儿时期曾有严重窒息、缺血缺氧性脑病、遗传代谢串联质谱异常、其他宫内感染(如风疹病毒、弓形虫、单纯疱疹病毒Ⅰ或Ⅱ型、梅毒等);随访期内曾诊断遗传代谢病、严重颅脑外伤、除HCMV以外的中枢神经系统感染、染色体异常等可导致神经系统发育异常的疾病。随访时间不足3年。通过电子病历查询临床资料,收集先天性HCMV感染新生儿的出生胎龄、性别、出生体重、临床表现、实验室检查、听力检测数据、影像学资料等。患儿每3~6个月到门诊随访神经系统发育情况,随访期间完善听力、神经系统影像资料,电话随访患儿各年龄段运动、语言、听力、视力发育情况,至2019年3月,21例患儿随访至3~5岁。参照《诸福棠实用儿科学》第8版有以下情况考虑运动发育落后[4],7月龄不能从俯卧位翻身,9月龄不能从仰卧位翻到俯卧位,10月龄不能独坐,18月龄不能独走,2岁不能跑,3岁不能跳。以下情况考虑语言发育落后,1~4月龄对母亲声音无应答;5~7月龄咿呀发音少;8~12月龄不咿呀学语;13~20月龄听不懂简单的吩咐;18~24月龄不说有意义的字;24~30月龄不执行吩咐;30~36月龄语不成句或完全不为陌生人听懂;3~4岁口语单调、依靠手势表达;5~6岁说话快慢、节奏或语调变化异常。3.新生儿听觉脑干诱发电位(auditory brainstem response,ABR)听力测试:由专业人员进行测试,测试系统为北京中科电气高科技公司生产的IEP-300诱发电位仪。以能引出可重复的V波的最小声压级作为ABR的阈值。听力损失程度按照世界卫生组织对耳聋的分级标准进行分级,轻度26~40 dBnHL、中度41~55 dBnHL、中重度56~70 dBnHL、重度71~90 dBnHL、极重度>90 dBnHL。神经系统影像包括头颅超声(head ultrasound, HUS)、CT、头颅磁共振成像(magnetic resonance imaging, MRI),所有影像的评价均请放射科医生进行Alarcon评分[3],放射科医生不知晓患儿的临床资料及分组,即为盲法。5.Taqman探针荧光定量PCR检测尿液、痰液或血液HCMV gH基因型:采用RTFQ PCR法同时进行HCMV定量及gH基因分型,仪器采用ABI7500荧光定量PCR仪(美国应用生物系统公司)。利用荧光杂交探针在一次PCR反应中同时检测和鉴别HCMV gH1和HCMV gH2基因型。该方法能够快速、稳定、明确区分两种HCMV gH基因型[5]。在gH基因两端的保守区设计引物,正向引物序列:TGTTTTCACGCAGGAAGCGG,反向引物序列:TGGATCACGCCGCTGAACC。在gH基因的分型位置设计两种探针,一种探针识别gH1型,另一种探针识别gH2型。gH1型探针5′端用FAM标记,3′端用BHQ1标记,序列:FAM-CATCCGAAG CGCTGGACCCTCACG-BHQ1;gH2型探针5′端用HEx标记,3′端用BHQ1标记,序列:HEX-TATCCG AACCGCTGGACAAAGCG-BHQ1。引物、探针均由宝生物公司(日本大津市)合成。应用SPSS 14.0统计软件进行统计学分析。经正态性检验后,符合正态分布的计量资料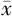
±s表示,组间比较采用t检验;非正态分布计量资料用M(范围)表示,组间比较用非参数检验;计数资料用例(%)表示,组间比较用χ2检验。P<0.05为差异有统计学意义。
共21例先天性巨细胞病毒感染新生儿进行HCMV-DNA gH基因分型,标本来源血液1例,痰液2例,尿液18例;男12例、女9例;gH1型14例(67%)、gH2型7例(33%),未发现混合型。IgM阳性率19%(4/21),IgG阳性率52%(11/21),其中1例IgM和IgG均阳性,7例均阴性。gH1组与gH2组男性比例采用Fisher概率法比较差异无统计学意义(9/14比3/7,P=0.397),出生体重差异亦无统计学意义[(2 609±686)比(3 021±451)g,t=-1.436,P=0.167]。gH1组出生胎龄小于gH2组[38(29~40)比39(38~40)周,Z=-2.18,P=0.029],其中4例早产儿均感染gH1型。两组病毒载量对数差异无统计学意义(5.2±1.6比5.9±1.5,t=-0.955,P=0.352)。21例患儿出现HCMV相关临床表现见表1,gH1型组有SGA、血小板减少各3例,脾肿大、肝肿大、胆汁淤积各2例,淤斑1例;gH2型组有SGA 2例,颅内钙化、视网膜炎各1例。两组均未发现小头畸形、肝功能损害。15例患儿(gH1型9例、gH2型6例)行眼底检查,gH2组1例HCMV改变,表现为眼底颞侧、黄斑周围大范围灰白色渗出。两种基因型出现症状性感染比例差异无统计学意义(7/14比2/7,Fisher概率法,P=0.642)。共20例(40耳)新生儿行ABR检查,包括gH1型11例(22耳),gH2型9例(18耳)。两组出现听力损失患儿的比例差异无统计学意义(6/11比4/9,Fisher概率法,P=1.000)。将40耳听力损失程度分正常、轻度、中度、中重度、重度、极重度6级,出现中重度及以上听力损失患耳的比例gH1组(4/22)较gH2组(0/18)高(χ2=5.145,P=0.023)。所有患儿均行头颅影像学检查。其中7例单行HUS检查、2例HUS联合CT、12例HUS联合MRI检查。出现的异常影像学表现主要有:室管膜下囊肿、室管膜下出血、脉络丛囊肿、脉络丛回声增强、脑实质回声增强、侧脑室扩张、侧脑室出血、脑室周围钙化灶、脑白质异常信号、巨脑回畸形、皮层发育不良等。典型HCMV相关病变见图1。神经系统影像学检查Alarcon评分gH1组(0.4±0.3)较gH2组(1.3±1.1)低(t=-2.459,P=0.024)。图1 典型人巨细胞病毒(HCMV)感染患儿相关神经系统病变影像学表现 A:头颅CT示脑室扩张伴脑室周围弥漫钙化灶(白色箭头);B:头颅磁共振成像(MRI)T2WI象限示弥漫性脑白质信号异常(白色箭头);C:头颅MRI T1WI象限示脑室扩张伴巨脑回畸形(白色箭头);D:头颅MRI T1WI象限示皮层发育不良(白色箭头)21例患儿随访至3~5岁,gH1组和gH2组随访时间差异无统计学意义[(4.0±0.7)比(4.6±0.9)年,t=-1.354,P=0.192]。运动和语言发育正常13例,运动或语言发育落后8例(gH1型和gH2型各4例),未发现明显听力障碍病例,1例伴有视力异常。其中4例出现脑发育落后(gH1型和gH2型各2例)。gH2组出现运动或语言发育落后的概率与gH1组差异无统计学意义(4/7比4/14,Fisher概率法,P=0.346)。8例运动或语言异常儿童中2例gH2型感染新生儿期为无症状感染。
HCMV是造成宫内感染常见的病原体之一,容易导致死胎、流产、宫内发育迟缓,活产儿临床表现主要为肝脏损害、血小板减少、视网膜炎、听力损失、小于胎龄儿、小头畸形、颅内钙化和智力低下等,对于儿童的健康和生长发育造成了严重的威胁。全世界活产婴儿先天性HCMV感染的发生率为0.6%~0.7%,症状性感染约占12.7%,有症状的儿童中发生永久后遗症概率为40%~58%,无症状性感染中7%~15%发生SNHL[6,7,8]。我国先天性巨细胞病毒感染率约为0.23%[9]。HCMV所致SNHL是儿童非遗传性SNHL的最主要原因,且呈进行性损害[8]。有症状性先天性HCMV感染患儿长期随访研究发现,74%出现听力损失,31%出现智力损害,18%出现视力损害[10]。目前国内外关于先天性HCMV感染gH分型的研究较少,Paradowska等[11]研究发现,波兰地区gH基因分布以gH2型为主,在先天性感染和后天性感染患儿中无差异,gH1型感染与听力损失、尿液高DNA载量存在明显相关性。Ikuta等[12]研究发现,母体针对HCMV gH基因中和表位的抗体主要来自IgG3亚型,可以通过胎盘传给胎儿,但母体体液免疫不能预防先天性HCMV感染另一gH亚型。本研究分型结果显示,浙江地区先天性HCMV感染gH1型占67%,gH2型占33%,未分离出混合型,与Paradowska等[11]研究以gH2型为主不一致,可能存在地域差异。有研究显示,浙江地区输卵管妊娠孕妇的生殖道组织分离出HCMV感染以gH1型为主(50%),存在混合型(20%)[13],可能混合型感染活产概率较低。gH1组出生胎龄较gH2组小,4例早产儿均为gH1组,两组出生体重差异无统计学意义。由于本组样本量少,HCMV感染对早产儿的影响有待于日后增加样本量进一步研究。在临床表现上,本研究两组尿液病毒载量差异无统计学意义。2例脾肿大患儿均为gH1型感染,3例血小板减少患儿均为gH1型感染,何政贤等[14]研究发现HCMV AD169(gH1型)对造血系统有直接损害作用,而郭珊等[15]研究发现血小板减少症患儿中gH2型为主。故不同基因型HCMV对造血系统的影响尚需进一步研究。先天性HCMV感染是导致儿童非遗传性SNHL重要的原因。一项2年的听力随访研究发现,先天性HCMV感染患儿听力损失发生率39.5%,其中新生儿期发生率7.9%,且往往导致中重度以上的听力损失[16]。目前对HCMV感染导致听力损失的发病机制不明。巨细胞病毒诱导小鼠耳聋模型研究显示,巨细胞病毒通过引起内耳炎症反应和螺旋神经神经元减少导致听力损失,炎症反应起主要作用[17]。本组早期中重度以上听力损失以gH1型感染为主,这与以往的研究一致[11],不同gH基因型别HCMV致听力损失是否存在致病机制上的不同尚需进一步研究。头颅MRI影像学表现上,HUS、MRI、CT对不同颅内病变各有优势,临床联合检查能起到互补作用,本研究神经系统影像评分依据Alarcon评分。已有研究显示,该评分比过去使用的Noyola评分更敏感[18,19]。评分越高,神经系统不良结局可能性越大。本研究gH1组Alarcon评分较gH2组低,提示gH2型感染容易出现神经系统损害。gH2组出现运动或语言发育落后的比例与gH1组差异无统计学意义,但可能跟样本量少有关。临床标准株TOWNE株的基因型为gH2、gB1、gN4b、gO4,已有研究发现,在先天性HCMV感染中gN4型毒力最强,容易导致神经系统损害[20],其中gN4b与gO4存在遗传连锁[21],而与gH2、gB1是否存在一定遗传连锁关系尚少见研究。根据本组结果,gH2型可能更容易出现神经系统损害,提示该基因型可能对神经细胞的侵袭性更强。周玉峰等[22]研究发现,小鼠巨细胞病毒可抑制神经干细胞分化,这可能是先天性HCMV感染致脑发育异常的重要机制。一项系统评价分析认为无症状先天性HCMV感染没有增加患儿神经系统损害的风险[23],本研究8例运动或语言异常中2例gH2型新生儿期为无症状感染。由于样本量少,无症状gH2型感染是否增加神经系统发育落后风险需进一步研究。本研究神经系统发育评估缺乏量表评分,有待日后扩大样本量、完善神经系统发育量表评估继续研究。综上所述,gH1型感染较gH2型感染患儿出生胎龄小。新生儿期中重度及以上听力损失以gH1型感染为主。gH2型先天性HCMV感染出现神经系统损害可能性较大。参考文献(略) |